-
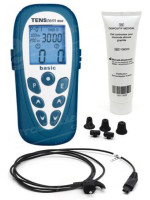
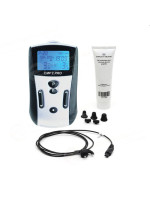
CHF 369,00
Vagusnerv-Stimulation
Vagusnerv-Stimulation
Der Vagusnerv (auch als Parasympathikus-Nerv bekannt) ist der Hirnnerv mit dem größten Territorium (daher sein Name). Es ist ein sehr wichtiger Weg der vegetativen Regulierung (Verdauung, Herzfrequenz...), der die Übertragung von Nervenimpulsen ermöglicht. Der Vagusnerv stellt die Verbindung zwischen dem Zentralnervensystem und dem Verdauungstrakt her. Es handelt sich um einen gemischten Nerv, der zu 80% aus afferenten und zu 20% aus efferenten Fasern besteht und motorische, sensorische und vor allem parasympathische vegetative Informationen übermittelt. Es besitzt entzündungshemmende Eigenschaften sowohl über seine afferenten Fasern, die in der Lage sind, die kortikotrope Achse als Reaktion auf Immunstress zu aktivieren, als auch über seine efferenten Fasern. Tatsächlich ist die Freisetzung von Acetylcholin am Ende seiner efferenten Fasern in der Lage, die Freisetzung von TNF durch Makrophagen zu hemmen. Diese Anti-TNF-Eigenschaft des Vagusnerv kann bei der Behandlung von chronisch entzündlichen Darmerkrankungen, aber auch bei rheumatoider Arthritis oder anderen Pathologien (Psoriasis, postoperativer Ileus, Reizdarmsyndrom...) eingesetzt werden.
Die vagale Neurostimulation, ob invasiv (neurochirurgisch) oder nicht-invasiv (transaurikulär), ist daher besonders interessant für einen nichtmedikamentösen Therapieansatz als Alternative zu konventionellen Anti-TNFs oder als Alternative zu medikamentösen Therapien (Bruno Bonaz. Clinique Universitaire d'Hépato-Gastroentérologie, CHU de Grenoble - Entzündungshemmende Eigenschaften des Vagusnerv: therapeutische Auswirkungen in der Gastroenterologie. Hegel Band 5 Nr. 3-2015).
Vagale Stimulation, theoretische Grundlage:
Die vagale oder parasympathische Stimulation kann die Produktion von Neurotransmittern (Adrenalin, Noradrenalin, Serotonin, Acetylcholin...) modulieren. Durch die Förderung der Sekretion von Acetylcholin bewirkt es eine Verlangsamung der Herzfrequenz, eine Verengung der Pupille (Miosis), eine Stärkung der Kontraktion der glatten Muskeln des Verdauungstraktes und eine Erhöhung der Pankreassekretion von Insulin und verdauungsfördernden Enzymen. Jede Störung des sympatho-vagalen Gleichgewichts, die das Gleichgewicht zwischen Sympathikus und Parasympathikus widerspiegelt, insbesondere im Sinne einer Vagusnervendysfunktion, kann eine entzündungsfördernde Wirkung haben. Jede Wiederherstellung dieses sympatho-vagalen Gleichgewichts dürfte daher einen entzündungsfördernden Prozess ausgleichen. Auch Stress spielt eine Rolle, da er zu einer vagalen Hemmung und Aktivierung des sympathischen Systems führt und damit die pro-inflammatorische Reaktion begünstigt. Abhängig von der Umgebung und den Umständen kann die vagale Stimulation (Stimulation des Parasympathikus) dem Körper helfen, das richtige Gleichgewicht zwischen sympathischen und para-sympathischen Systemen zu finden und damit ein gutes sympathisch-vagales Gleichgewicht, das die sympathische Aktivität reduziert. Seit ihren ersten Anwendungen bei der Behandlung der refraktären Epilepsie hat die vagale Neurostimulation auch bei anderen Indikationen, insbesondere bei chronischen Schmerzen, positive Wirkungen gezeigt. Seit mehreren Jahren werden in den Vereinigten Staaten und Europa nicht-invasive Lösungen zur transkutanen Stimulation entwickelt, die die Einführung neuer Studien und neuer Anwendungen erleichtern.
Die doppelte entzündungshemmende Rolle des Vagusnervs:
- einerseits über den klassischen Weg mit den zentripetal afferenten Vagalfasern, die die kortikotrope Achse aktivieren können.
- andererseits über den erst kürzlich beschriebenen entzündungshemmenden cholinergen Weg. Die entzündungshemmende Wirkung steht in diesem Fall in Zusammenhang mit der Aktivierung von zentrifugalen Vagalergüssen. Tatsächlich setzen die Enden dieser Fasern an der Peripherie Acetylcholin frei, das durch Bindung an den Alpha-7-Nikotinrezeptor, der insbesondere von Makrophagen exprimiert wird, die Sekretion von pro-inflammatorischen Zytokinen (insbesondere TNF-alpha hemmt).
Vagale Stimulation und Schmerz
De Jüngste Studien an Menschen und Tieren haben den Wert der vagalen Stimulation als Analgetikum hervorgehoben. Tatsächlich wurde bei der Behandlung von Epilepsiepatienten durch neuro-vagale Stimulation (mehr als 70.000 Implantate weltweit seit den 1990er Jahren) eine starke schmerzstillende Wirkung bei bestimmten Schmerzen auch bei Patienten beobachtet, die wegen Epilepsie behandelt wurden. Mechanismus: Vagal-Afferenzen hemmen die Nozizeptorreflexe im Rückenmark und deren Übertragung und haben starke entzündungshemmende Eigenschaften. Nach Gebhard und Randich (1992) bewirkt die elektrische Stimulation vagaler Afferenzen eine biphasische Modulation der nozizeptiven Reflexe der Wirbelsäule und der spinalen nozizeptiven Übertragung. Dies sind absteigende Wirkungen des Hirnstamms, die durch spinale Monoamin- und Opioidrezeptoren vermittelt werden. Die Studien zeigten auch, dass die Phänomene der Antinokokzeption und der Hemmung der spinalen nozizeptiven Übertragung, die durch intravenöse Morphininjektion erzielt wurden, ebenfalls durch vagale Afferenzen vermittelt wurden. Indem sie zeigen, dass vagale Afferenzen eine Rolle bei der Schmerzmodulation spielen, legen sie nahe, dass diese viszeralen Afferenzen eine zentrale Rolle im endogenen analgetischen System einnehmen. Die Hirn-Darm-Achse umfasst absteigende antinokzeptive Nervenbahnen, die mit den efferenten Bahnen aus den Hypothalamuskernen wandern. Sie sind am myenterischen Plexus verteilt und modulieren die Aktivität der afferenten Bahnen und insbesondere der Nozizeptor-Neuronen, die den Ursprung der Schmerzempfindungen darstellen. Die Aktivierung der absteigenden antinokzeptiven Bahnen könnte die Intensität der Reaktion der afferenten Neuronen und damit die Menge des in das ZNS gelangenden Zustroms verringern. Eine randomisierte Studie zur Schmerzbehandlung mit t-VNS, die 2011 an gesunden Freiwilligen durchgeführt wurde (Busch et al.), zeigte eine signifikante Reduktion der wahrgenommenen mechanischen Schmerzen. Eine zweite randomisierte Studie an 49 gesunden Freiwilligen, die an drei verschiedenen Tagen Schmerzprozesse in der linken und rechten Hand verglich zeigte, dass die t-VNS das Schmerzempfinden nach mechanischen Reizen signifikant reduziert Im Jahr 2015 untersuchte das Team von Largeron die Auswirkungen der transkutanen Nervenstimulation des Parasympathikus bei 21 Patienten mit postoperativen Schmerzen für 10 Minuten im Aufwachraum. Die transaurikuläre Stimulation zeigte eine signifikante Abnahme der EVA.
Gesichtsgefäßalgen
Eine prospektive randomisierte und kontrollierte Studie, die von Gaul et al. im Jahr 2015 an 48 Patienten durchgeführt wurde, die mit VNS (transkutan) bei der Behandlung von Cluster-Kopfschmerzen (AVF) behandelt wurden, zeigt eine signifikante Reduktion der wöchentlichen Attacken (Reduktion von 5,9 Attacken pro Woche in der Testgruppe gegenüber einer Reduktion von 2,1 in der Placebogruppe). Es sind keine Nebenwirkungen zu verzeichnen.
Chronische Migräne
Im Jahr 2015 führte Straube in Deutschland eine doppelblinde, randomisierte monozentrische klinische Studie zur Wirksamkeit der transkutanen Vagus-nervstimulation bei 46 Patienten mit chronischer Migräne durch. Die "1-Hz"-Gruppe erreichte eine durchschnittliche Reduktion von 7 Migränetagen pro Monat (36,4%), während die "25-Hz"-Gruppe nur eine durchschnittliche Reduktion von 3,3 Migränetagen pro Monat (17,4%) erreichte. 29,4% der Patienten in der "1-Hz"-Gruppe erreichten oder überstiegen eine Verbesserung der Reduktion der Anzahl der Tage um 50%, verglichen mit nur 13,6% der Patienten in der "25-Hz"-Gruppe. Die Intensität der Migräneanfälle hat in keine der beiden Gruppen wesentlich verändert. Protokoll: 4 Stunden Stimulation pro Tag für 3 Monate. Im Jahr 2016 evaluierte Silberstein die Wirksamkeit der nicht-invasiven Vagus-nervstimulation bei der Prävention von chronischer Migräne. Diese multizentrische, doppelblinde, placebokontrollierte Studie, die über einen Zeitraum von 6 Monaten an 59 Patienten (die durchschnittlich 21,5 Tage Migräne pro Monat erlitten) durchgeführt wurde, zeigte eine durchschnittliche Verringerung der Migräne pro Monat um 1,4 Tage nach 2 Monaten Behandlung (verglichen mit einer Verbesserung von 0,2 Tagen in der Placebo-Gruppe) und eine durchschnittliche Verringerung von 3,6 Tagen nach 8 Monaten Behandlung.
Becken-Perineal-Schmerzen
Napadow (2012) untersuchte die Auswirkungen der vagalen Neurostimulation über den transaurikulären Weg bei der Behandlung von Becken-Perineal-Schmerzen im Zusammenhang mit Endometriose. Um die Ergebnisse zu optimieren, wählte er die Hypothese einer elektrischen Stimulation nur während der Ausatmungsphase der Atmung. Er bewertete den tiefen Schmerz, der nach einer vagalen Vorhofstimulation in der Ausatmungsphase und den Schmerz, der nach einer nicht-vagalen Vorhof-stimulation evoziert wird, indem er die Intensität der tiefen Gewebe-schmerzen, die zeitliche Summenbildung (Schmerzen, die mit der Wiederholung zunehmen) und die Ängstlichkeit verglich. Die Ergebnisse zeigten eine signifikante Reduktion der Schmerzintensität (EVA), der zeitlichen Summierung (QST) und der Angst mit dem Verfahren der aktiven vagalen Stimulation, die um 50% höher war als die Ergebnisse, die mit der nicht-vagalen Stimulation (Placebo) erzielt wurden. Für Napadow ist diese nichtmedikamentöse, nicht-invasive Technik sowohl wegen ihrer antinokokzeptiven Wirkung als auch wegen ihrer Wirkung auf die zentrale Sensibilisierung vielversprechend.
Fibromyalgie
Lange et al. führten 2011 eine klinische Studie an 14 Patienten mit refraktärer Fibromyalgie durch, denen ein VNS-Stimulator implantiert wurde. 12 Patienten schlossen die anfängliche dreimonatige Studienphase ab, und 11 Patienten kehrten nach 5, 8 und 11 Monaten der Stimulation zu Nachuntersuchungen zurück. Die therapeutische Wirksamkeit wurde anhand der Schmerzreduktion, des verbesserten Wohlbefindens und der körperlichen Fähigkeiten der Patienten beurteilt. Nach 3 Monaten hatten 5 Patienten (36%) die festgelegten Wirksamkeitskriterien erreicht. Die therapeutische Wirksamkeit schien sich im Laufe der Zeit zu verbessern, wobei 57% der Patienten die Kriterien nach 8 Monaten und 50% der Patienten die Kriterien nach 11 Monaten erfüllten.
Gastrointestinaler Schmerz
(Reizdarmsyndrom, Reizdarm, Morbus Crohn)
Nach Clarençon, der die vagale Elektrostimulation bei Ratten anwendete, zeigen vorläufige experimentelle Daten das Interesse, den cholinergen Pfad durch Nervenstimulation zu aktivieren, um eine entzündungshemmende Wirkung im Verdauungstrakt zu erzielen. Die VNS könnte als potenzielles Therapeutikum für chronisch entzündliche Darmerkrankungen (Radiocolitis, IBD: Morbus Crohn, Colitis ulcerosa) beim Menschen in Betracht gezogen werden. Derzeit laufen mehrere klinische Studien zur Vagusnervstimulation als Behandlung von chronisch entzündlichen Darmerkrankungen und Morbus Crohn beim Menschen, darunter zwei Studien in Frankreich, deren erste Ergebnisse sehr ermutigend sind:
- NCT01569503 : Vagusnervstimulation als neuer Ansatz in der Behandlung von Morbus Crohn. VNS-Studie, die von Professor Bonaz vom Universitätskrankenhaus Grenoble an 7 implantierten Patienten durchgeführt wurde.
- NCT02420158 : Untersuchung des sympathovagalen Gleichgewichts bei Patienten mit Reizdarmsyndrom und Bewertung der Wirkung der transkutanen Vagusnervstimulation auf Symptome und Lebensqualität - StVSII-Studie, durchgeführt von Professor Mion an den Lyoner Zivilkliniken (Studie mit dem Urostim2-Gerät, Schwa-Medico). Laut Bonaz "betreffen die entzündlichen Darmerkrankungen (IBD), d.h. Morbus Crohn (CD) und Colitis ulcerosa, mehr als 2 Millionen Menschen in Europa. Die Pathophysiologie der IBD umfasst immunologische, genetische und Umweltfaktoren. Die Behandlung ist medizinisch-chirurgisch, aber aufschiebend. Anti-TNF-Wirkstoffe haben die Behandlung von IBD revolutioniert, haben aber Nebenwirkungen. Darüber hinaus bricht ein signifikanter Prozentsatz der IBD-Patienten die Behandlung ab oder nimmt sie episodisch ein. Daher wäre eine nichtmedizinische Therapie, die darauf abzielt, TNF über einen physiologischen Weg ohne größere Nebenwirkungen und mit guter Kostenwirksamkeit zu verringern, von Interesse.
Der Vagusnerv hat zwei entzündungshemmende Eigenschaften: einerseits durch seine afferente Achse (d.h. die Hypothalamus-Hypophysen-Nebennieren-Achse) und andererseits durch die efferenten Fasern (cholinerger antiinflammatorischer Weg).
Laut Bonaz "haben wir gezeigt, dass es eine umgekehrte Beziehung zwischen dem vagalen Tonus und den TNF-Spiegeln im Plasma bei Patienten mit Morbus Crohn gibt, und wir haben zum ersten Mal gezeigt, dass die chronische Nervenstimulation des vagalen Weges entzündungshemmende Eigenschaften in einem Ratten-Colitis-Modell und in einer Pilotstudie bei sieben Patienten mit moderatem Morbus Crohn hat. Bei zwei dieser Patienten gab es nach 3 Monaten Vagusnervstimulation keine Verbesserung, aber fünf von ihnen befanden sich nach 6 Monaten in tiefer Remission, klinisch, biologisch und endoskopisch. Der Vagalton wurde wiederhergestellt. Es wurden keine signifikanten Nebenwirkungen beobachtet. Die Vagusnervstimulation stellt somit eine neue therapeutische Option in der Behandlung des Morbus Crohn dar. (Bonaz, Vagusnervstimulation: ein neues vielversprechendes therapeutisches Mittel bei entzündlichen Darmerkrankungen, J Intern Med. 2017 Jul;282(1):46-63).
Rheumatoide Arthritis
In den vergangenen Jahren haben mehrere amerikanische Forscher und Ärzte in Tier- und Humanmodellen gezeigt, dass die neuralen Reflexschaltungen die Zytokin-produktion und Entzündung hemmen. Einer der Zytokin-hemmenden Mechanismen wird als "Entzündungsreflex" bezeichnet (von Tracey im Jahr 2000 hervorgehoben).
Laut van Maanen spielen Neurotransmitter, einschließlich alpha7-Nikotinrezeptoren, eine wichtige Rolle bei der Modulation von Entzündungen. Laut Koopman, der eine Studie mit einem implantierten Gerät bei 17 Patienten mit rheumatoider Arthritis durchführte, könnte die vagale Neurostimulation die Produktion von TNF in den peripheren Blutzellen hemmen und die Entzündung reduzieren. Er beobachtete ein Ungleichgewicht im sympatho-vagalen Gleichgewicht bei vielen Patienten mit Autoimmunerkrankungen einschließlich rheumatoider Arthritis und deutet an, dass dieses Ungleichgewicht bei dem Individuum bereits vor der Entwicklung von Arthritis vorhanden sein könnte. Seiner Meinung nach steuert das autonome Nervensystem die Entzündung. Eine Stimulation der entzündungshemmenden cholinergen Wege, entweder durch elektrische Stimulation der vagalen Afferenzen oder durch pharmakologische Aktivierung von alpha7-Nikotinrezeptoren, würde die klinischen Anzeichen und Symptome der Arthritis durch eine Verringerung der Zytokinproduktion verbessern und so das Gelenk vor fortschreitender Knorpelzerstörung schützen. Laut Das hemmt Acetylcholin, der wichtigste Neurotransmitter im Vagusnerv, die Entzündung, indem es die Produktion von pro-inflammatorischen Zytokinen durch einen Mechanismus unterdrückt, der vom alpha-7-nikotinischen Acetylcholin-Rezeptor, insbesondere seiner Untereinheit (alpha7nAChR), abhängt, was erklärt, warum die Stimulation des Vagusnerv entzündungshemmend ist. Laut Levine kann der Schweregrad der kollageninduzierten Arthritis durch eine (vagale) Neurostimulation des entzündungshemmenden cholinergen Signalwegs verringert werden.
Postoperativer Ileus
Darüber hinaus zeigen Daten nach de Jonge (2003), dass während des postoperativen Ileus eine Aktivierung der peritonealen Makrophagen während der Mobilisierung der Eingeweide stattfindet, die über eine Freisetzung von TNF durch diese Makrophagen zum Ileus führt. Die pharmakologische Stimulation der NV, insbesondere durch nikotinische Alpha7-Agonisten oder durch Neurostimulation, geht mit einer Hemmung des postoperativen Ileus einher.
Tinnitus
Im Jahr 2015 zeigte eine koreanische Studie (Hyun Joon), dass die Stimulation des Vagusnervs in Verbindung mit Musiktherapie wirksam zur Verringerung von Tinnitus beitragen kann. Dreißig Patienten, die seit mehr als 12 Monaten an chronischem, refraktärem Tinnitus leiden, wurden durch Stimulation der Ohrmuschel des linken Ohres mit einem TENS ECO2-Gerät für 30 Minuten pro Tag in Kombination mit Musiktherapie eingeschlossen. Bei 16 der 25 Patienten (64%), die den abschließenden Fragebogen beantworteten, nahm die Intensität des Tinnitus nach 10 Therapiesitzungen ab (EVA vorher - EVA nachher): 3 Patienten berichteten über eine Abnahme von -4, 3 Patienten über eine Abnahme von -2, 4 Patienten über eine Abnahme von -2 und 6 Patienten über eine Abnahme von 1.
Das finnische Team von Lehtimäki und Ylikoski hat gezeigt, dass psychischer Stress in Verbindung mit einer Dysbalance des autonomen Nervensystems zu einer Verringerung der parasympathischen Aktivität führt. Diese Studie wurde an 24 Patienten durchgeführt, die an mäßigem bis schwerem Tinnitus leiden, wobei die Stimulation des aurikulären Zweigs des Vagusnerv mit Musiktherapie kombiniert wurde. Protokoll: eine einzige 60-minütige kontinuierliche Sitzung. Bei 23 der 24 Patienten wurde Tinnitus als Zusammenhang mit psychischem Stress diagnostiziert. Nach der 60-minütigen Sitzung konnte der Stress bei 23 von 24 Patienten reduziert werden (gemessen anhand der Herzfrequenzvariabilität). Ylikoski konnte damit zeigen, dass die t-VNS einen echten Einfluss auf stressbedingten Tinnitus hat, mit guter Verträglichkeit und ohne echte Nebenwirkungen.
Veröffentlichungen zur vagalen Stimulation:
Hier eine Liste der wichtigsten neueren Studien, die den Wert der vagalen Stimulation zeigen.
Vagale Stimulation im Allgemeinen
-
Ben-Menachem et al (2015) « Surgically implanted and non-invasive vagus nerve stimulation: a review of effi cacy, safety and tolerability », European Journal of Neurology, vol. 22, p. 1260- 1268
-
Clancy et al (2014). “Non-invasive vagus nerve stimulation in healthy humans reduces sympathetic nerve activity”. Brain stimulation
-
Frangos et al (2015) « Non-invasive access to the vagus nerve central projections via electrical stimulation of the external ear: fMRI evidence in humans.” Brain stimulation. “central projections of the ABVN are consistent with the “classical” central vagal projections and can be accessed non-invasively via the external ear.”
-
Capone et al (2015). “The effect of transcutaneous vagus nerve stimulation on cortical excitability”. Journal of Neural Transmission. Our fi ndings confirm that tVNS is a safe and effective way to stimulate vagus nerve”.
-
La Marca et al. Effects of auricular electrical stimulation on vagal activity in healthy men: evidence from a three-armed randomized trial. Clinical Science (2010) 118, 537–546
-
Ellrich. Transcutaneous Vagus Nerve Stimulation. European Neurological Review, 2011;6(4):254–6
-
Howland. Vagus Nerve Stimulation. Curr Behav Neurosci Rep. 2014 June ; 1(2): 64–73
-
Peuker, E. T., and Filler, T. J. (2002). The nerve supply of the human auricle. Clin. Anat. 15, 35–37.
Vagale Stimulation und entzündungshemmende Reflexe
-
Tracey, K. J. (2002). The inflammatory refl ex. Nature, 420(6917), 853-859.
-
Wang et al (2003). Nicotinic acetylcholine receptor a7 subunit is an essential regulator of inflammation. Nature, 421(6921), 384-388.
-
Borovikova et al (2000) “Vagus nerve stimulation attenuates the systemic inflammatory response to endotoxin”. Nature, 405(6785), 458-462.
-
Borovikova et al (2000) Role of vagus nerve signaling in CNI-1493-mediated suppression of acute inflammation. Auton. Neurosci. 85:141–147
-
Olofsson et al (2015) “Single-pulse and unidirectional electrical activation of the cervical vagus nerve reduces tumor necrosis factor in endotoxemia”. Bioelectron Med, 2, 37-42.
-
Tracey et al (2007). Physiology and immunology of the cholinergic anti-inflammatory pathway. The Journal of clinical investigation, 117(2), 289-296.
-
Ulloa, L. (2005). The vagus nerve and the nicotinic anti-inflammatory pathway. Nature Reviews Drug Discovery, 4(8), 673-684.
-
Lerman et al (2016). Non-invasive Transcutaneous Vagus Nerve Stimulation Decreases Whole Blood Culture-Derived Cytokines and Chemokines: A Randomized, Blinded, Healthy Control Pilot Trial.
-
Oke SL, Tracey KJ (2009). The Inflammatory Reflex and the Role of Complementary and Alternative Medical Therapies. Ann N Y Acad Sci 1172: 172-180.
-
Popa C (2007). The role of TNF-alpha in chronic inflammatory conditions, intermediary metabolism, and cardiovascular risk. J Lipid Res 48(4): 751-762.
Chronische Schmerzen
-
Busch et al. The effect of transcutaneous vagus nerve stimulation on pain perception - an experimental study. Brain Stimul. 2013 Mar;6(2):202-9.
-
Kirchner et al. [Vagus nerve stimulation - a new option for the treatment of chronic pain syndromes?]. Schmerz. 2001 Aug;15(4):272-7. [Article in German]
-
Kirchner, A., Birklein, F., Stefan, H., Handwerker, H.O. Left vagus nerve stimulation suppresses experimentally induced pain. Neurology. 2000;55:1167–1171.
-
Multon et al. Pain control by vagus nerve stimulation: from animal to man...and back. Acta Neurol Belg. 2005 Jun;105(2):62-7.
-
Ness et al. Low intensity vagal nerve stimulation lowers human thermal pain thresholds. Pain. 2000 May;86(1-2):81-5.
-
Ellrich et al. Analgesic Effects of Transcutaneous Vagus Nerve Stimulation (136). Poster sessions. North American Neuromodulation Society; 15th Annual Meeting, December 8–11, 2011 , Las Vegas, USA
-
Chakravarthy et al. Review of the Uses of Vagal Nerve Stimulation in Chronic Pain Management. Curr Pain Headache Rep. 2015 Dec;19(12):54.
-
Randich et al. Vagal afferent modulation of nociception. Brain Res Brain Res Rev. 1992 May- Aug;17(2):77-99.
-
Aicher SA, Lewis SJ, Randich A. Antinociception produced by electrical stimulation of vagal afferents: independence of cervical and subdiaphragmatic branches. Brain Res 1991;542:63–70.
-
Bohotin C, Scholsem M, Multon S, Martin D, Bohotin V, Schoenen J. Vagus nerve stimulation in awake rats reduces formalin-induced nociceptive behaviour and fos-immunoreactivity in trigeminal nucleus caudalis. Pain 2003;101:3–12.
-
Ren K, Randich A, Gebhart GF. Electrical stimulation of cervical vagal afferents. I. Central relays for modulation of spinal nociceptive transmission. J Neurophysiol 1990;64:1098 –1114.
-
Vanegas H, Schaible HG. Descending control of persistent pain: inhibitory or facilitatory? Brain Res Rev 2004;46:295–309
-
Millan, M.J. Descending control of pain. Prog Neurobiol. 2002;66:355–474.
-
Suzuki R, Rahman W, Hunt SP, Dickenson AH. Descending facilitatory control of mechanically evoked responses is enhanced in deep dorsal horn neurones following peripheral nerve injury. Brain Res 2004;1019:68 –76.
-
Terayama R, Guan Y, Dubner R, Ren K. Activity-induced plasticity in brain stem pain modulatory circuitry after inflammation. Neuroreport 2000;11:1915–1919
-
Largeron et al. Effet sur la douleur de la stimulation nerveuse transcutanée du parasympathique au niveau de l’oreille. Anesthésie & Réanimation. Volume 1, Supplement 1, September 2015, Pages A394-A395
Fibromyalgie
-
Lange et al (2011). Safety and efficacy of vagus nerve stimulation in fibromyalgia: a phase I/II proof of concept trial. Pain Medicine, 12(9), 1406-1413. Etude sur 14 patients.
Gastrointestinalschmerzen (Reizdarmsyndrom, Reizdarm, Morbus Crohn usw.)
-
Bonaz (2015). Propriétés anti-inflammatoires du nerf vague : implications thérapeutiques en gastroentérologie. Hegel Vol. 5 N° 3-2015.
-
Bonaz et al (2013) Vagus nerve stimulation: from epilepsy to the cholinergic anti-inflammatory pathway. Neurogastroenterol Motil 2013;25:208–21.
-
Julien Meregnani (2009) Effet anti-inflammatoire de l’électrostimulation vagale appliqué à un modèle de colite expérimentale. Sciences du Vivant [q-bio]. Université Joseph-Fourier - Grenoble I, 2009.
-
Marshall et al. Bioelectrical Stimulation for the Reduction of Inflammation in Inflammatory Bowel Disease. Clinical Medicine Insights: Gastroenterology 2015:8 55–59 doi:10.4137/ CGast.S31779.
-
Levine (2012). Vagus Nerve Stimulation Reduces Inflammation of the Small Intestinal Mucosa in the Indomethacin-Induced Enteropathy Model: P.193. Inflammatory Bowel Diseases, 18, S92.
-
Browning et al. The Vagus Nerve in Appetite Regulation, Mood, and Intestinal Inflammation. Gastroenterology 2017;152:730–744
-
Matteoli G, Boeckxstaens G. The vagal innervation of the gut and immune homeostasis. Gut 2013; 62:1214. Review of the role of the inflammatory reflex in the gut, and potential for treating inflammatory bowel disease and other GI inflammatory disorders
-
Pellissier et al. Relationship between vagal tone, cortisol, TNF-alpha, epinephrine and negative affects in Crohn’s disease and irritable bowel syndrome. PLoS One 2014;9:e105328.
-
Clarençon et al. Effet anti-inflammatoire de l’électrostimulation vagale chez le rat : application à un modèle de colite expérimentale. Gastroentérologie Clinique et Biologique
Viszeral- und Beckenschmerzen
-
Zurowski et al. Effects of vagus nerve stimulation in visceral pain model. Folia Med Cracov. 2012;52(1- 2):57-69.
-
Chen et al. Subdiaphragmatic vagal afferent nerves modulate visceral pain. Am J Physiol Gastrointest Liver Physiol 294: G1441–G1449, 2008.
-
Zhang et al. Vagus nerve stimulation modulates visceral pain-related affective memory. Behav Brain Res. 2013 Jan 1;236(1):8-15.
-
Browning KN (2015) Role of central vagal 5-HT3 receptors in gastrointestinal physiology and pathophysiology. Front. Neurosci.9:413.
-
Napadow (2012). Evoked Pain Analgesia in Chronic Pelvic Pain Patients Using Respiratory- Gated Auricular Vagal Afferent Nerve Stimulation. Pain medicine, 13(6), 777-789. Etude sur 15 patientes
-
Udoji (2013) « New directions in the treatment of pelvic pain », Pain management, Vol 3, N°5. Review
Postoperativer Ileus
-
Gao et al. Role of the vagus nerve on the development of postoperative ileus. Langenbecks Arch Surg. 2010 Apr;395(4):407-11
-
Lubbers et al. Controlling postoperative ileus by vagal activation. World J Gastroenterol 2010; 16(14): 1683 -1687
-
de Jonge et al. Postoperative ileus is maintained by intestinal immune infiltrates that activate inhibitory neural pathways in mice. Gastroenterology 2003 Oct;125(4):1137-47.
Rheumatoide Arthritis
-
Koopman et al. Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. 8284–8289 | PNAS | July 19, 2016 | vol. 113 | no. 29
-
Koopman et al. Balancing the autonomic nervous system to reduce inflammation in rheumatoid arthritis. J Intern Med 2017; 282: 64–75.
-
Bruchfeld A, et al. Whole blood cytokine attenuation by cholinergic agonists ex vivo and relationship to vagus nerve activity in rheumatoid arthritis. J Intern Med. 2010; 268:94–101.
-
Goldstein et al. Cholinergic Anti-Inflammatory Pathway Activity and High Mobility Group Box-1 (HMGB1) Serum Levels in Patients with Rheumatoid Arthritis. | Mol. Med. 13 (3-4) 210-215, March-April 2007
-
Koopman (2012). Pilot study of stimulation of the cholinergic anti-inflammatory pathway with an implantable vagus nerve stimulation device in patients with rheumatoid arthritis. Arthritis Rheum, 64(10 Suppl), S195.
-
Koopman (2014). Vagus nerve stimulation: a new bioelectronics approach to treat rheumatoid arthritis ? Best Practice & Research Clinical Rheumatology, 28(4), 625-635.
-
Koopman FA, Tang MW, Vermeij J et al. Autonomic dysfunction precedes development of rheumatoid arthritis: a prospective cohort study. EBioMedicine 2016; 6: 231–7.
-
Sundman (2014). Neural control of the immune system. Advances in physiology education, 38(2), 135-139.
-
Levine al. Neurostimulation of the cholinergic anti-inflammatory pathway ameliorates disease in rat collagen-induced arthritis. PLoS ONE 2014; 9: e104530.
-
van Maanen (2009). The cholinergic anti-inflammatory pathway: towards innovative treatment of rheumatoid arthritis. Nature Reviews Rheumatology, 5(4), 229-232.
-
van Maanen et al. Role of the cholinergic nervous system in rheumatoid arthritis: aggravation of arthritis in nicotinic acetylcholine receptor alpha7 subunit gene knockout mice. Ann Rheum Dis 2010; 69: 1717–23.
-
Das, U. N. (2011). Can vagus nerve stimulation halt or ameliorate rheumatoid arthritis and lupus?. Lipids in health and disease, 10(1), 1.
-
Thayer, J. F., & Sternberg, E. M. (2010). Neural aspects of immunomodulation: focus on the vagus nerve. Brain, behavior, and immunity,24(8), 1223-1228.
-
Zhang et al. Inhibition of the development of collagen-induced arthritis in Wistar rats through vagus nerve suspension: a 3-month observation. Inflamm Res 2008; 57: 322–8.
-
Straub et al. Involvement of the hypothalamic–pituitary–adrenal/gonadal axis and the peripheral nervous system in rheumatoid arthritis: viewpoint based on a systemic pathogenetic role. Arthritis Rheum 2001; 44: 493–507.
-
Waldburger et al. Acetylcholine regulation of synoviocyte cytokine expression by the alpha7 nicotinic receptor. Arthritis Rheum 2008; 58: 3439–49.
-
Zitnik RJ. Treatment of chronic inflammatory diseases with implantable medical devices. Ann Rheum Dis 2011; 70 (Suppl 1): i67–70.
-
Kerlund et al. Anti-inflammatory effects of a new tumour necrosis factor-alpha (TNF-alpha) inhibitor (CNI-1493) in collagen-induced arthritis (CIA) in rats. Clin Exp Immunol 1999; 115: 32– 41.
-
Holman AJ, Ng E. Heart rate variability predicts antitumor necrosis factor therapy response for inflammatory arthritis. Auton Neurosci 2008; 143: 58–67
-
Sharma P, Makharia GK, Ahuja V, Dwivedi SN, Deepak KK. Autonomic dysfunctions in patients with inflammatory bowel disease in clinical remission. Dig Dis Sci 2009; 54: 853–61.
-
Adlan AM, Lip GY, Paton JF, Kitas GD, Fisher JP. Autonomic function and rheumatoid arthritis
Chronische Migräne
-
Silberstein, S., DaSilva, A. and Calhoun, A. (2015). Prevention of chronic migraine headache with noninvasive vagus nerve stimulation: results from the prosepective, double blind, randomized, sham-controlled pilot EVENT study. In: 17th Congress of the International Headache Society, Valencia, Spain
-
A.J. Mosqueira, L. López-Manzanares, B. Canneti, A. Barroso, E. García-Navarrete, A. Valdivia, J. Vivancos. Vagus nerve stimulation in patients with migraine
-
Hord ED, Evans MS, Mueed S, Adamolekun B, Naritoku DK. The effect of vagus nerve stimulation on migraines. J Pain. 2003;4(9):530-4.
-
Kinfe, T. M., Pintea, B., Muhammad, S., Zaremba, S., Roeske, S., Simon, B. J., & Vatter, H. (2015). Cervical non-invasive vagus nerve stimulation (nVNS) for preventive and acute treatment of episodic and chronic migraine and migraine-associated sleep disturbance: preliminary findings from a prospective observational cohort study. The journal of headache and pain.
-
Garcia et al. Modulation of brainstem activity and connectivity by respiratory-gated auricular vagal afferent nerve stimulation in migraine patients. Pain: August 2017 - Volume 158
-
Magis, D., Gerard, P. and Schoenen, J. (2012) Transcutaneous vagus nerve stimulation (tVNS) for headache prophylaxis: initial experience. In: The European Headache and Migraine Trust International. Congress, London.
Yuan, H. and Silberstein, S. (2015b) Vagus nerve stimulation and headache. Headache.
Clusterkopfschmerzen
-
Gaul et al. Non-invasive vagus nerve stimulation for PREVention and Acute treatment of chronic cluster headache (PREVA): A randomised controlled study. Cephalalgia 2016, Vol. 36(6) 534–546
-
Mauskop A. Vagus nerve stimulation relieves chronic refractory migraine and cluster headaches. Cephalalgia. 2005
-
Nesbitt et al. (2015) Initial use of a novel noninvasive vagus nerve stimulator for cluster. headache treatment. Neurology 84: 1249–1253.
-
Oshinsky et al. (2014) Noninvasive vagus nerve stimulation as treatment for trigeminal allodynia. Pain 155: 1037–1042.
Tinnitus
-
Tian-Tian Li (2015) « Transcutaneous electrical stimulation at auricular acupoints innervated by auricular branch of vagus nerve pairing tone for tinnitus: study protocol for a randomized controlled clinical trial », Trials, vol. 16, p. 101.
-
Hoare et al. Electrical Stimulation of the Ear, Head, Cranial Nerve, or Cortex for the Treatment of Tinnitus: A Scoping Review. Neural Plasticity. Volume 2016, Article ID 5130503, 15 pages
-
Lee et al (2014). Effectiveness of transcutaneous electrical stimulation for chronic tinnitus, Acta Oto-Laryngologica, 134:2, 159-167
-
Hyun Joon et al. Feasibility and Safety of Transcutaneous Vagus Nerve Stimulation Paired with Notched Music Therapy for the Treatment of Chronic Tinnitus. J Audiol Otol 2015;19(3):159-167
-
De Ridder et al. Placebo-controlled vagus nerve stimulation paired with tones in a patient with refractory tinnitus: a case report. Otol Neurotol. 2015Apr;36(4):575-80.
-
Hyvärinen et al. Transcutaneous Vagus Nerve Stimulation Modulates Tinnitus-Related Beta- and Gamma-Band Activity. Ear & Hearing 2015;36:e76–e85)
-
Lehtimäki et al, (2013) Transcutaneous vagus nerve stimulation in tinnitus: a pilot study, Acta Oto-Laryngologica, 133:4, 378-382
Fettleibigkeit
-
Banni (2012), Berthoud (2008), Vijgen (2013) sur 13 patients, Gil (2011), Bodenlos (2007)
-
Burneo et al. Weight loss associated with vagus nerve stimulation. Neurology. 2002 Aug 13;59(3):463-4.
-
Pavlov & Tracey. The vagus nerve and the inflammatory reflex—linking immunity and metabolism. Nat Rev Endocrinol. 2012 December ; 8(12)
-
Bodenlos. Vagus nerve stimulation and food intake: effect of body mass index. J Diabetes Sci Technol. 2014 May;8(3):590-5.
-
Bodenlos et al. Vagus nerve stimulation and emotional responses to food among depressed patients. J Diabetes Sci Technol. 2007 Sep;1(5):771-9.
-
Gil. Electrical vagus nerve stimulation decreases food consumption and weight gain in rats fed a high-fat diet. J Physiol Pharmacol. 2011 Dec;62(6):637-46.
-
Parekh et al. The role and infl uence of gut microbiota in pathogenesis and management of obesity and metabolic syndrome Frontiers in Endocrinology -April 2014 | Volume 5 | Article 47.
-
Pardo et al. Weight loss during chronic, cervical vagus nerve stimulation in depressed patients with obesity: an observation. Int J Obes (Lond). 2007 November ; 31(11): 1756–1759
-
Vijgen et al. (2013) Vagus Nerve Stimulation Increases Energy Expenditure: Relation to Brown Adipose Tissue Activity. PLoS ONE 8(10): e77221. • Tracey KJ (2005) Fat meets the cholinergic anti-inflammatory pathway. J Exp Med 202(8): 1017-1021. 3. • Val-Laillet et al. Chronic vagus nerve stimulation decreased weight gain, food consumption and sweet craving in adult obese minipigs. Appetite 2010
Bluthochdruck und Herzpathologien
-
Gierthmuehlen et al. Effect of selective vagal nerve stimulation on blood pressure, heart rate and respiratory rate in rats under metoprolol medication. Hypertens Res. 2016 Feb;39(2):79-87
-
Gierthmuehlen et al. Blood pressure control with selective vagal nerve stimulation and minimal side effects. J Neural Eng. 2014 Jun;11(3):036011
-
Kreuzer et al. (2012). Transcutaneous vagus nerve stimulation: retrospective assessment of cardiac safety in a pilot study. Frontiers in psychiatry.